|
Tiềm năng ứng dụng của nấm Purpureocillium lilacinum trong nông nghiệp
Thứ sáu, 11-08-2017 | 09:02:57
|
|
Trong những năm gần đây, một nhóm các loài nấm đã nổi lên như một tác nhân sinh học đầy hứa hẹn cho kiểm soát tuyến trùng ký sinh thực vật. Chúng được gọi là nhóm nấm “cơ hội” vì ký sinh một số giai đoạn của tuyến trùng bất cứ khi nào có cơ hội tiếp xúc (Trivedi, 2012), đó là Purpureocillium lilacinum hay còn được gọi là Paecilomyces lilacinus (Thom) Samson.
 Hình 1. Tản nấm Purpureocillium lilacinum sau 10 ngày phát triển trên môi trường thạch PDA (A) và hình thái vi thể của nấm Purpureocillium lilacinum khi chụp dưới kính hiển vi huỳnh quang 100X (B).
Purpureocillium lilacinum (P. lilacinum) là nấm hoại sinh, có sẵn trong đất, phát triển nhanh và trong một thời gian ngắn sẽ trở thành loài ưu thế ở nơi sử dụng nó (Siddiqui và Mahmood, 1997). P. lilacinum còn ít bị ảnh hưởng bởi nhiều loại thuốc diệt nấm, diệt cỏ và diệt tuyến trùng (Villanueva và Davide, 1983; Kumar và Ramya, 2014).
Trong phòng thí nghiệm P. lilacinum lây nhiễm trứng Meloidogyne incognita và phá hủy phôi trong năm ngày. Hệ khuẩn ty xâm nhập qua lớp vỏ trứng nhờ lực cơ học và/hoặc hoạt động của enzmye (Siddiqui và Mahmood, 1997). Quá trình lây nhiễm bắt đầu với sự phát triển của khuẩn ty nấm trong chất nền gelatine (Siddiqui và Mahmood, 1997). Khuẩn ty nấm xâm nhập thông qua các lỗ nhỏ của màng vitelline, gây ra sự thay đổi tính thấm của vỏ và sự nở trứng. Khuẩn ty nấm lan rộng sau khi xuyên qua lớp vitelline, phá vỡ lớp vỏ chitin và lớp lipid liền kề đó. Tiếp theo, hệ khuẩn ty xâm nhập cả trứng bao bọc ấu trùng, tiếp tục tạo khuẩn ty nội sinh, phá hủy vỏ trứng và tạo các cuống đính bào tử mang chuỗi bào tử (Morgjan-Jones và cộng sự, 1984; Bird, 1991). P. lilacinum còn sản sinh enzyme serine protease và một số chitinase phá hủy vỏ trứng (Moosavi và Zare, 2012).  Hình 2. P. lilacinum xâm nhiễm và kí sinh trứng tuyến trùng M. javanica khi được chụp dưới kính hiển vi điện tử quét (Holland và cộng sự, 2003). (1) Sợi nấm áp ép trên bề mặt trứng M. javanica 5 ngày sau khi ủ rễ/ sinh khối trứng với P. lilacinus. Thước 10µm. (2) Sợi nấm trên bề mặt rễ cà chua. Thước 10µm. (3) bào tử P. lilacinus trên bề mặt rễ cà chua. Thước 10µm. (4) Bào tử P. lilacinus nảy mầm trên bề mặt trứng M. javanica sau 2 ngày. Sợi nấm phát triển dọc theo bề mặt trứng. Thước 1µm.
Theo Jatala và cộng sự (1979), P. lilacinum xâm nhiễm con cái Meloidogyne thông các lỗ mở của cơ thể như hậu môn và âm hộ. Tuy nhiên nghiên cứu của Khan và cộng sự (2006) lại cho thấy, khuẩn ty nấm xâm nhập trực tiếp vào biểu bì của con cái, con cái rất dễ bị tổn thương bởi P. lilacinum. Có một số lượng lớn đính bào tử nấm bao quanh cơ thể con cái. Do đó, có thể những enzyme tạo ra từ P. lilacinum giúp cho khuẩn ty xâm nhiễm qua biểu bì của con cái. Kết quả này cũng giống với những nghiên cứu của Pau và cộng sự (2012). Các enzyme còn giúp P. lilacinum xâm nhiễm vào lớp biểu bì ở các giai đoạn phát triển khác nhau của ấu trùng (Khan và cộng sự, 2006). 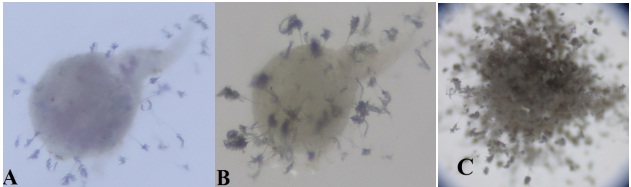 Hình 3. Tuyến trùng Meloidogyne sp. cái bị nấm Purpureocillium lilacinum ký sinh khi chụp dưới kính soi nổi ở vật kính 10X. A: Sau 4 ngày chủng nấm, B: Sau 8 ngày chủng nấm, C: Sau 14 ngày chủng nấm.
Ngoài ra, P. lilacinum có khả năng đối kháng với một số loại nấm bệnh khác như: ngăn chặn sự nảy mầm của các hạch nấm Aspergillus flavus và Aspergillus parasiticus (Gupta và cộng sự, 1993; Will và cộng sự, 1994), kiểm soát sinh học Rhizoctonia solani (Cartwright và Benson, 1995), ức chế Colletotrichum vanillae, Phytophthora meadii và đối kháng 100% với Fusarium oxysporum f. sp. vanillae (Bhai và cộng sự, 2009). P. lilacinum kiểm soát một số ký sinh trùng như: ký sinh giun đũa Ascaris lumbricoides; ký sinh trứng sán chó Toxocara canis (Basualdo và cộng sự, 2000), phá hủy trứng sán bò Taenia saginata (Araújo và cộng sự, 2010) và phá hủy con cái, trứng, ấu trùng ve chó Rhipicephalus microplus (Angelo và cộng sự, 2012), P. lilacinum ký sinh các loại côn trùng như bọ xít Triatoma infestans (Marti và cộng sự, 2006), ruồi đục trái Bactrocera cucurbitae (Amala, 2013), rầy nâu Nilaparvata lugens (Rombach và cộng sự, 1986), kiểm soát mạt Aculus schlechtendali gây hại táo. Kiểm soát hầu hết các loại côn trùng gây hại nghiêm trọng ở nhà kính như: ruồi trắng Trialeurodes vaporariorum, nhện đỏ Tetranychus urticae, rệp bông Aphis gossypii và bọ trĩ Frankliniella occidentalis (Fiedler và Sosnowska, 2007). Ngoài ra, P. lilacinum còn có khả năng trừ sâu ăn tạp Spodoptera litura, mọt đậu xanh Callosobruchus chinenis (Trần Duy Thảo, 2009). Do đó, nấm này có tiềm năng để ứng dụng phòng trừ nhiều dịch hại do côn trùng và tuyến trùng gây ra trên nhiều loại cây trồng ở nước ta. TÀI LIỆU THAM KHẢO
Lê Thị Mai Châm - Hcmbiotech. |
|
|
|
[ Tin tức liên quan ]___________________________________________________
|


 Đang trực tuyến :
Đang trực tuyến :
 Số lượt truy cập :
Số lượt truy cập :






















